Validación técnica ≠ decisión de compra en biotech
Quién valida, quién decide y por qué el ciclo real es mucho más largo de lo que parece
Publicado 30 de enero de 2026 · Categoría: Empresas · Estrategia y dirección

En biotech, la validación técnica suele llegar antes que la validación de negocio. El compuesto funciona. El dispositivo mide. El ensayo confirma lo esperado.
Y con eso aparece una sensación peligrosa: “ya estamos listos”. Listos para escalar, para levantar capital, para salir al mercado. Pero lo que suele estar validado es la ciencia, no el mercado.
Funcionar en laboratorio no es lo mismo que tener mercado. Y no es un matiz: es una diferencia estructural que, si se confunde, cuesta foco, equipo y capital.
- Validar tecnología no es validar mercado: cambia quién decide, cómo decide y cuánto tarda.
- En biotech, el riesgo no es “no vender”: es diseñar la empresa para un ciclo de venta que no existe.
- El problema rara vez es la ciencia. Es el timing del salto y la estructura para sostenerlo.
1. El error que se repite en biotech
Durante años, el sistema de incentivos en biotech empuja en una sola dirección: demostrar que la tecnología funciona. Publicaciones, grants, validaciones técnicas, hitos científicos. Todo el progreso se mide ahí.
Ese recorrido entrena a los equipos para asumir que validar es avanzar. El problema aparece cuando se da por hecho que ese avance técnico equivale a estar preparado para vender.
Ahí empieza el desgaste: se consume foco, equipo y capital en una dirección que todavía no es sostenible. Este patrón se repite más de lo que parece. Y casi siempre se detecta tarde.
2. Qué significa realmente “validar mercado” en biotech
Validar mercado en biotech no significa que “hay interés”. Tampoco que alguien diga que lo compraría. Validar mercado implica, como mínimo, tres cosas.
- Identificar quién compra, no quién valida. El validador técnico rara vez es el decisor económico.
- Entender cómo se decide. Comités, terceros, regulatorio y presupuestos marcan el ritmo real.
- Alinear ciclo de venta con estructura. Burn rate, equipo y expectativas deben encajar con el calendario real.
No es casualidad que la financiación se concentre cada vez más en historias de-risked. En la práctica, el listón de lo que significa “estar listo” se ha movido: ya no basta con ciencia; se exige prueba tangible y un camino viable hacia mercado.
Referencia (para el lector que quiera profundizar): análisis de financiación biopharma con foco en “clinical-stage” y oportunidades más de-risked. William Blair · Biopharma Quarterly Review.
3. Tres fricciones habituales cuando se confunden ambas validaciones
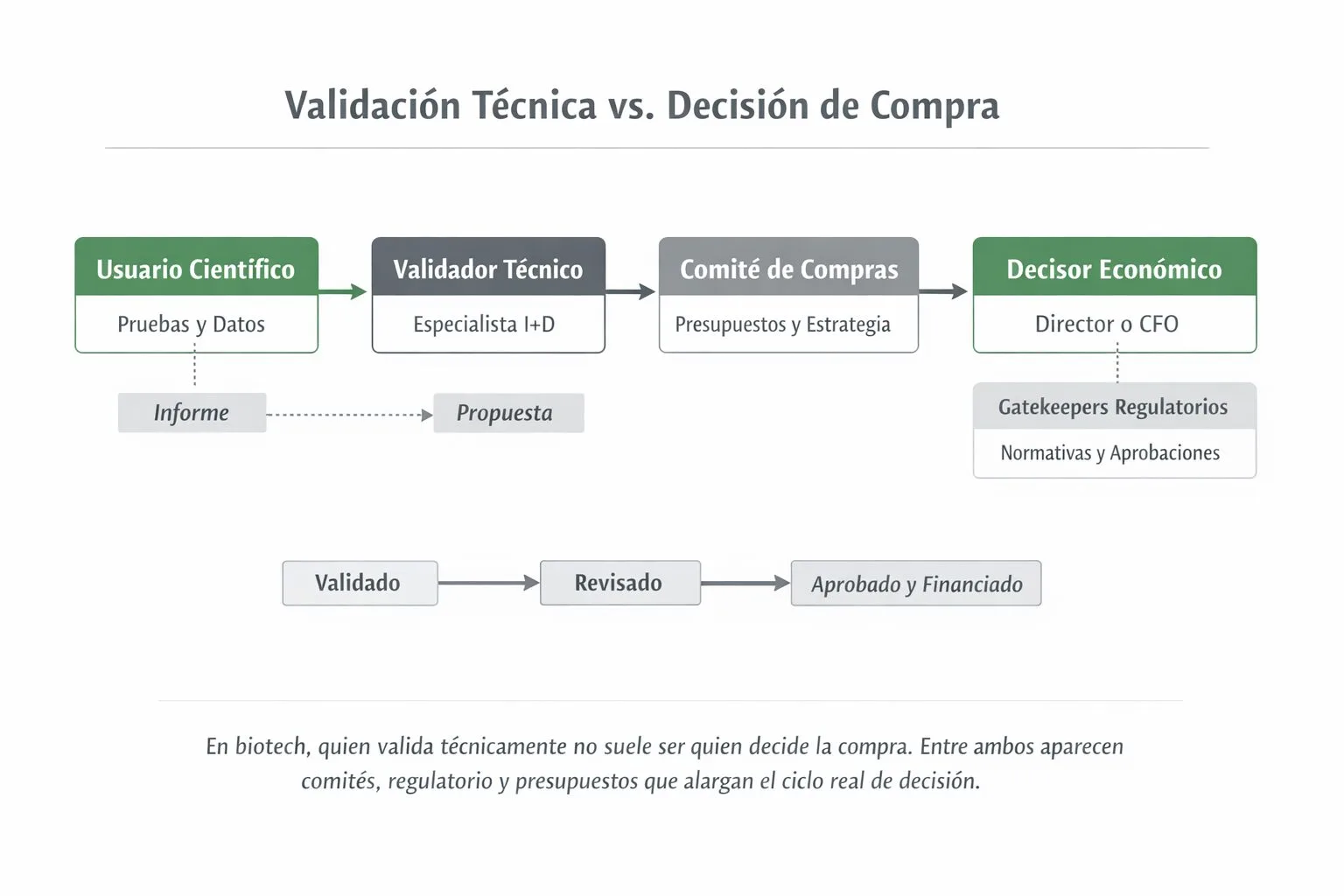
Fricción 1 · El comprador no es quien usa la solución
En biotech, los roles están fragmentados: quien usa no decide, quien decide no usa, y quien valida técnicamente no paga. Confundir estas figuras genera “señales positivas” que no activan una decisión de compra real.
Fricción 2 · El ciclo de venta real llega demasiado tarde
La tecnología puede estar lista, pero la organización no. Cuando el ciclo real se descubre ya en salida al mercado, suele ser más largo de lo previsto. La empresa aguanta técnicamente, pero no organizativamente.
Fricción 3 · El coste oculto de “salir a vender” antes de tiempo
Salir a vender consume personas, foco y energía directiva. Si se hace demasiado pronto, se improvisa narrativa, se tensiona el equipo y se generan expectativas internas insostenibles.
Este coste oculto se vuelve más visible en mercados donde la presión competitiva ya no es solo tecnológica. Incluso dentro del sector, una parte relevante de directivos señala la presión de genéricos y biosimilares como un factor que condiciona estrategia: diferenciar implica acceso al mercado y valor justificable, no solo “mejor tecnología”.
Referencia: encuesta a ejecutivos del sector life sciences (2026) sobre tendencias y presiones competitivas. Deloitte · 2026 Life Sciences Executive Outlook.
4. El problema no es la ciencia, es el timing
Esto se malinterpreta a menudo. No es falta de ambición. No es conservadurismo. No es “esperar más”. Es decidir cuándo el salto al mercado es sostenible, y cómo hacerlo sin quemar capital ni equipo.
En biotech, el timing no lo marca solo la madurez técnica. Lo marca también la complejidad de evidencia, coordinación y regulación que exige el camino hacia comercialización. Eso añade pasos y tiempo que no siguen el ritmo del laboratorio.
- Si el ciclo real es largo y tu estructura está diseñada para uno corto, el problema no es “ventas”: es diseño.
- Si sales antes de poder sostener el proceso de decisión, el aprendizaje se distorsiona y el desgaste se dispara.
- Retrasar no es frenar: puede ser preparar el terreno para avanzar de forma sostenible.
Referencias regulatorias (marco, no “hype”): uso de Real-World Evidence y tecnologías digitales para captura de datos en investigación clínica. EMA · Real-World Evidence · FDA · Digital Health Technologies (guía).
5. Cierre: dirección antes que aceleración
En biotech, acelerar no siempre es avanzar. A veces avanzar es ordenar. A veces avanzar es decidir qué no toca todavía. A veces avanzar es sostener una estructura coherente con la realidad del mercado, no con el deseo de llegar antes.
La confusión entre validar tecnología y validar mercado no es un error menor. Es una fuente recurrente de desgaste silencioso en startups científicas.
Diseñar bien el paso del laboratorio al mercado no es una cuestión de marketing. Es una cuestión de dirección.
¿Te avisamos cuando publiquemos nuevos contenidos?
Nos tomamos en serio tu tiempo. Solo te enviaremos artículos, guías o herramientas que te ayuden a mejorar, decidir o actuar mejor.
Nuestros recursos prácticos y herramientas on-line
Checklist dirección de proyectos de infraestructura verde
Evalúa si tu municipio cuenta con la capacidad necesaria para dirigir y coordinar proyectos de infraestructura
Checklist modelos operativos del verde urbano
Identifica en pocos minutos si tu municipio cuenta con un modelo operativo sólido para la gestión
Checklist comunicación ciudadana en medio ambiente
Comprueba en minutos si tu municipio comunica de forma eficaz sus iniciativas ambientales y logra implicar
Checklist estrategia de infraestructura verde y azul
Evalúa en 2 minutos si tu municipio cuenta con la base necesaria para avanzar en infraestructura